Коррозионный износ
Коррозия - процесс превращения металла в окисленное состояние. В результате окисления металлы теряют электроны и образуют оксиды, гидрооксиды или соли. По механизму взаимодействия металлов со средой различают химическую и электрохимическую коррозию.
К химической коррозии относятся процессы взаимодействия металлов с сухими газами и жидкими органическими веществами, не проводящими электрического тока. Процессы коррозии во всех прочих средах водных растворов солей, кислот, щелочей, атмосфере и в других газах, содержащих влагу, представляющих собой ионные проводники электрического тока - электролиты, имеют электрохимическую природу. По условиям протекания процессов коррозия многообразна, причем следует отметить, что часть видов коррозии происходит одновременно с процессом механического износа. Особое место занимает биокоррозия, протекающая и по химическому, и по электрохимическому пути.
Специфичными видами электрохимической коррозии являются щелевая, контактная и фретинг-коррозия. При щелевой коррозии узкий зазор препятствует проникновению кислорода к металлу и на нем не образуются защитные оксидные пленки (не происходит пассивации), а проникающий электролит увеличивает скорость коррозии в щели. Фретинг-коррозия происходит при колебательном перемещении соприкасающихся деталей в основном под воздействием вибрации. Фретинг-коррозия характерна для наружных поверхностей колец подшипников качения,
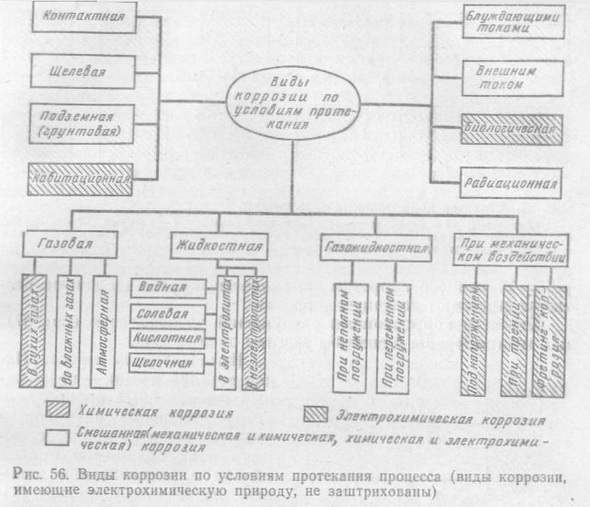
поверхностей отверстий в корпусах подшипников и т. п. При контактной коррозии разрушается поверхность деталей из разнородных металлов, обладающих в электролитах различными потенциалами. Разрушению подвержена деталь из металла с более отрицательным потенциалом. Так, в водных нейтральных растворах недопустимы контакты алюминия со сталью и др.
Интенсивной электрохимической коррозии подвержены рассольные системы холодильных установок. Коррозионный процесс усугубляется окислительным действием кислорода воздуха, растворенного в рассоле, особенно в открытых рассольных системах. При электрохимической коррозии на поверхности металла вследствие его неоднородности образуются гальванические пары. Зерна металла, обладая более низким потенциалом, являются анодом, а частицы примесей и неметаллов в присутствии электролита играют роль катода. На аноде образуется ион металла, уходящий в электролит, в то время как электроны по металлу перемещаются на катод, где и связываются растворенными в воде или растворе кислородом или водородом. Образующиеся ионы гидроокислов соединяются в электролите с ионами металлов и образуют продукты коррозии. Особенно сильно идет коррозия в кислых средах при рН < 7. В щелочных средах при рН > 10 процесс коррозии замедляется, однако щелочные растворы вызывают точечную коррозию.
Характер коррозионных разрушений разнообразен, как многообразны и способы защиты от коррозии.
От: PoljakovA,
Скрыть комментарии (0)
| UP |
Похожие темы: